先天性甲状腺激素功能低下症(甲减),是由甲状腺激素分泌不足导致的最常见的内分泌紊乱之一。世界范围内新生儿中发病率高达1:1,400-1:2,800。在临床中,20-60%甲减患者表现贫血或者免疫缺陷等症状,然而分子机制却不明确。尽管甲状腺激素替代是治疗甲减患者的常用方法,然而相关报道表明对于一些严重的甲减且并发贫血的患者而言,通过服用甲状腺激素并不能完全治愈,说明甲状腺激素严重缺乏所带来的损害并不是完全可逆的。
适宜的动物模型对于解析疾病的发病机制从而研发新药或者开发新的治疗手段至关重要。相较于小鼠等模式动物而言,猪作为大动物不仅与人类器官大小,生理生化等性状相近,在甲状腺激素代谢和免疫等方面与人类更接近,而且更为重要的是猪甲状腺可以作为天然甲状腺激素的最主要来源之一,所以猪非常适合作为模拟人类甲减的动物模型。
在孟安明院士和周琪院士的倡导和推动下,中国科学院动物研究所牵头成立了“中国猪化学诱变联盟”,利用ENU化学诱变技术高效地创制了大量的猪疾病模型和突变体 (eLife, 2017),并发现了一例先天性无毛突变体隐性遗传的家系。在本研究中,通过表型分析发现该突变体表现为与人类接近的严重甲减特征。基于家系的全基因组连锁分析和全基因组测序成功定位了致病基因DUOX2。该基因发生了点突变,即c.1226A>G 转换导致相应的氨基酸序列D409G的改变。同时利用CRISPR/Cas9系统在正常猪中敲除该基因相应的区域,发现突变体表型与ENU诱变获得的表型一致,进一步证实了DUOX2为该家系的致病基因。
DUOX2协同其成熟因子DUOXA2 产生H2O2。在甲状腺甲状腺激素合成中,H2O2作为甲状腺过氧化物酶的底物,而过氧化物酶参与甲状腺球蛋白酪氨酸残基的碘化和碘化酪氨酸的耦联过程,该步骤是甲状腺激素合成中的限速步骤。D409G突变位于DUOX2 中的peroxidase-like 功能域,该突变导致DUOX2蛋白稳定性严重下降。体内和体外实验同时证实,该突变使甲状腺中H2O2的产生减少。综上所述,由于D409G 突变破坏了DUOX2蛋白稳定性,进而影响甲状腺中H2O2的产生,从而引发甲状腺激素合成减少。
对该甲减猪模型的表型深入研究发现,其同时表现严重的贫血和免疫缺陷症状。为了进一步挖掘甲减和贫血及免疫缺陷之间的分子机制,对胸腺组织进行转录组测序,发现了一个关键的转录因子KLF9在突变体的胸腺组织中表达量显著下降。胸腺作为T淋巴细胞产生的主要器官,推测KLF9可能影响造血细胞的产生。通过体内外实验证实猪KLF9基因在造血细胞中以依赖于甲状腺激素的方式直接受甲状腺激素受体的调控。为了证实KLF9作为甲状腺激素受体的直接下游基因是否影响造血的发生,进一步利用斑马鱼模型证实:敲低Klf9后,成熟的红细胞和T淋巴细胞减少。其可能的分子机制是Klf9通过调控细胞凋亡和分裂过程最终影响了红细胞的成熟和T淋巴细胞的生成。
该工作创制了首例猪甲减模型,并首次发现KLF9作为一个关键的因子介导甲状腺激素受体调控造血和免疫细胞的发生,从而揭示了甲减患者贫血和免疫缺陷的潜在原因,为人类甲减的精准医疗研究提供理论支撑;同时也为培育高免疫力的新品系猪和猪的健康养殖提供了理论基础。相关论文以题目“Thyroid hormone regulates hematopoiesis via TR-KLF9”于2017年9月25日在线发表于Blood杂志。
中国科学院动物研究所干细胞与生殖生物学国家重点实验室博士生张颖、助理研究员曹春伟博士和膜生物学国家重点实验室博士生薛媛媛为共同第一作者, 中国科学院动物研究所赵建国研究员、刘峰研究员和第三军医大学魏泓教授为共同通讯作者。该课题得到了中国科学院战略性先导科技专项、国家转基因专项、国家自然科学基金、国家基础研究计划和863计划等项目的资助。(论文链接)
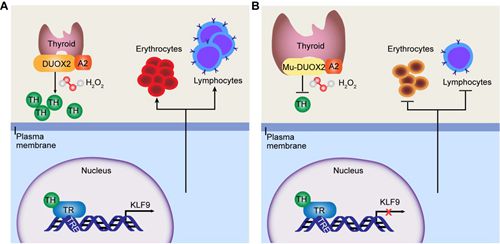
甲状腺激素通过TR-KLF9轴影响红细胞和淋巴细胞生成的模式图

