卵母细胞在减数分裂成熟的过程中积累大量的母源RNA和蛋白质,这些母源RNA和蛋白质在合子基因组激活之前调控卵母细胞向胚胎转变(oocyte-to-embryo transition)过程,即早期胚胎发育的母源调控。受研究材料和方法的限制,哺乳动物胚胎发育母源调控的分子机制研究相对滞后。中国科学院动物研究所干细胞与生殖生物学国家重点实验室李磊研究组长期从事相关过程的分子机制研究。
2008年,李磊博士以小鼠为模型,鉴定出哺乳动物功能性母源蛋白复合体SCMC(subcortical maternal complex),发现该复合体至少由MATER、FLOPED、TLE6以及FILIA四种蛋白组成,并且SCMC的缺失导致小鼠早期胚胎发育停滞于2-细胞阶段。此后,李磊研究组以SCMC为基础开展了一系列研究:证明Tle6是哺乳动物中一个新的母源效应基因,TLE6通过稳定SCMC在小鼠早期胚胎发育中行使功能,并进一步证实SCMC通过调控F-actin动态变化维持受精卵均等分裂;对SCMC组分蛋白质结构进行了解析,发现其中FILIA的N-端包含一个非典型的KH结构域,并证明其具有RNA结合能;发现在人类卵母细胞和着床前胚胎中,MATER、FLOPED、TLE6和FILIA形成人类 hSCMC(human SCMC)。与此同时,国际及国内同行纷纷加入SCMC相关研究,并陆续报道人类SCMC基因突变与女性生殖疾病密切关联。
最近,研究组又鉴定了SCMC的一个新组分ZBED3,并证明Zbed3为新的小鼠母源效应基因,它通过调控卵母细胞和受精卵中细胞器的重排进而调控小鼠早期胚胎发育,该工作还探讨了SCMC与哺乳动物卵母细胞和着床前胚胎中特异存在的结构-胞质晶格(cytoplasmic lattices,CPLs)之间的关系,有望为很早就发现但组成和功能一直未知的CPLs做出新的诠释。相关结果发表在The Journal of Molecular Cell Biology。(文章链接)
上述研究表明SCMC已经成为哺乳动物卵母细胞向胚胎转变过程中的关键功能枢纽之一。近日,李磊研究组受Trends in Molecular Medicine邀请以Opinion形式为SCMC撰写题为“A Maternal Functional Module in Mammalian Oocyte-To-Embryo Transition”的综述论文。论文介绍了SCMC的发现和最新研究进展,同时表述了上述观点。该观点的提出不仅有助于对哺乳动物、尤其是人类早期胚胎发育的理解,还可为人类生殖医学等提供参考。(文章链接)
李磊研究组的工作得到科技部、国家自然科学基金委和中国科学院等项目的资助。
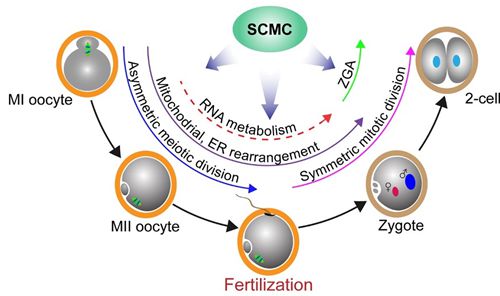
SCMC在哺乳动物卵母细胞向胚胎转变过程中的功能 (Lu et al., Trends in Molecular Medicine, 2017)

