基因在时空上的正确表达及其精密有序的调控是细胞生长、增殖、分化、衰老及凋亡等重要生理过程有序进行的前提和基础。相应的,通过可控的方式,从分子水平实现对基因功能的精确操控对于实现对生物学机制更精确的解析和更可控更安全的临床应用都有极为重要的意义。
王宇研究组致力于通过化学生物学手段发展新颖有用的分子和细胞生物学工具。他们提出通过在CRISPR/Cas9系统上嫁接雌激素受体元件(ERT2),使其在细胞内的核定位受到小分子药物4-羟他莫昔芬(4OHT)的调控,从而建立一种药物诱导型的CRISPR/Cas9技术(HIT,Hybrid drug Inducible CRISPR/Cas9 Technologies),从分子水平更加灵活准确的操控功能事件。他们从转录激活系统入手,对多种技术方案经过一系列优化、改造、对比之后,建立了一套低本底、高效率的药物诱导系统(HIT-SunTag)。在此基础上,他们又利用不同长度的sgRNAs可以选择性引导Cas9蛋白结合和剪切靶DNA的特性,建立了一套可以同时实现药物诱导的基因组编辑和转录激活的系统(HIT2,寓意 “一箭双雕”)。进一步地,他们背靠背地和现有的多种药物诱导系统(包括张锋实验室的Split-Cas9系统,David Liu实验室的intein系统等)进行了对比,HIT-SunTag和 HIT2系统呈现出更低本底、更高效率、更高药物选择特异性、以及可逆性及快速应答等多方面优势。这些系统的建立,为更加灵活多样、精准可控地编辑和调控基因功能,从而在解析关键生物学事件中实现更高时空“分辨率”提供了强大的技术工具,进而综合发挥小分子药物和基因治疗手段的优势,面向临床应用提供了更多的潜能。
这项研究工作以“Multimode drug inducible CRISPR/Cas9 devices fortranscriptional activation and genome editing”为题于2017年12月9日在国际重要杂志Nucleic Acids Research在线发表。硕士研究生卢佳、中国科学院动物研究所赵晨博士,赵迎泽博士、张竞方博士为本文共同第一作者。王宇研究员为本文通讯作者。该项研究得到了科技部国家重大科学研究计划(2015CB964800,2014CB964900)、国家自然科学基金(31571514, 21402195, 31401270)、干细胞与生殖生物学国家重点实验室开放课题基金的支持。
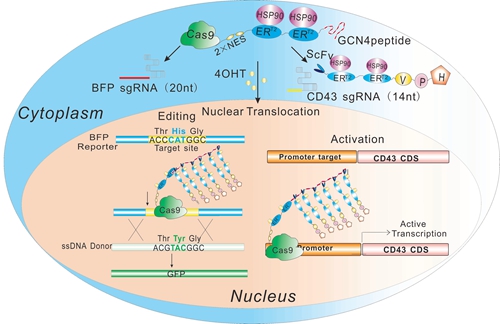
药物诱导实现基因组编辑和转录激活的HIT2系统作用机制

