在生物学研究中,如何对正常或病理状态下的动态生物系统进行有规律的操控,主要取决于是否可对靶细胞基因组进行有效而精准的调控。CRISPR/Cas9技术的出现,使针对特定位点的基因编辑以一种更为简便、自如的方式进行,而将药物调控元件与CRISPR/Cas9技术的融合则进一步拓展了其应用范围和模式,赋予它更高的精准性和可控性。这也为临床转化提供了更多的潜能。
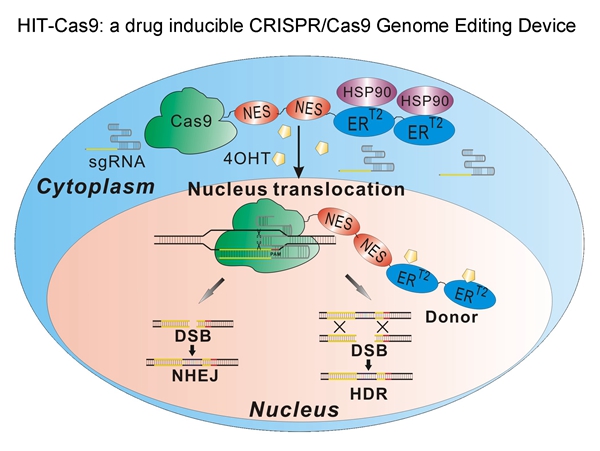
此前,王宇研究组报道了多种基于雌激素受体元件(ERT2)分别和CRISPR/Cas9以及TALE/TALEN系统嫁接的药物诱导装置,实现了针对特定基因的可控的转录激活和基因编辑,并进一步建立了可同时实现药物诱导的基因组编辑和转录激活的系统(HIT2)1, 2。本次发表的工作中,王宇研究组经过一系列的优化和改造,最终获得了一套兼顾较高的基因编辑活性和较低的背景活性的药物诱导系统(HIT-Cas9)。他们还在多种具有临床研究价值的细胞,如胚胎干细胞(H9)、间充质干细胞(MSC)和肿瘤细胞(HepG2)上测试了药物诱导的编辑效率,证实了该系统可在小分子药物4-羟他莫昔芬(4OHT)的调控下实现严格而有效的基因编辑。进一步,他们也和现有的多种药物诱导系统(包括intein、split、Tet-on 和iCas)进行了比较,HIT-Cas9在对药物的选择特异性、应答速度、脱靶率特别是对本底活性的控制方面显示出了较大的优势。这一系统的开发,使针对特定位点的遗传信息的改变可通过药物控制以一种更加精准的方式进行,结合他们所开发的其他药物调控系统,为基础研究中更精准更多样的生物学功能干预以及面向临床应用实现更安全可控的基因治疗提供了更加丰富的工具和更多的选择。
这项研究工作以“HIT-Cas9: a CRISPR/Cas9 Genome Editing Device Under Tight and Effective Drug Control” 为题于2018年8月31日在Cell旗下Molecular Therapy-Nucleic Acids在线发表。中国科学院动物研究所赵晨博士,赵迎泽博士、张竞方博士为本文共同第一作者。王宇研究员为本文通讯作者。该项研究得到了中科院先导专项、科技部国家重大科学研究计划、国家自然科学基金的支持。与此同时,王宇课题组针对这一系列的药物诱导的基因编辑和调控系统申报了四项发明专利。
论文链接:
https://www.sciencedirect.com/science/article/pii/S2162253118302373
https://academic.oup.com/nar/article/46/5/e25/4716932
https://pubs.acs.org/doi/10.1021/acschembio.7b00606
1. Lu, J, Zhao, C, Zhao, Y, Zhang, J, Zhang, Y, Chen, L, et al. (2018). Multimode drug inducible CRISPR/Cas9 devices for transcriptional activation and genome editing. Nucleic acids research 46: e25.
2. Zhao, C, Zhang, Y, Zhao, Y, Ying, Y, Ai, R, Zhang, J, et al. (2018). Multiple Chemical Inducible Tal Effectors for Genome Editing and Transcription Activation. ACS chemical biology 13: 609-617.

