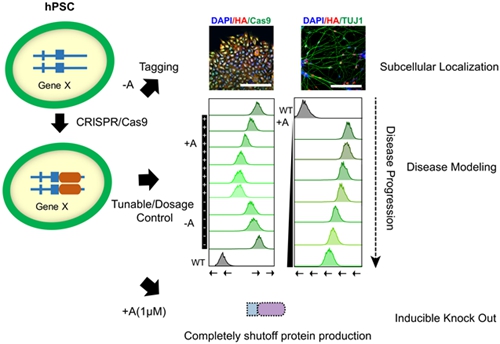
蛋白剂量水平将直接影响细胞命运决定和疾病发生。同一基因,如FOXG1,由于突变类型不同,会导致蛋白剂量差异,从而诱发多样化的症状。由于传统的敲除、敲降策略都难以精确调控蛋白表达水平,FOXG1综合征等类似蛋白剂量差异诱发疾病的研究进展缓慢。
人类多能干细胞(hPSCs)分化可模拟人类早期发育和相关疾病。为了在hPSCs及其分化细胞中精确调控蛋白剂量,通过利用CRISPR/Cas9在hPSCs中引入小分子药物(ASV)敏感的降解决定子(degron),并耦联目标蛋白基因,动物研究所/干细胞与再生医学创新研究院研究团队建立了一个可诱导的、可逆的蛋白剂量精确调控系统,从而可通过ASV浓度精确调控目标蛋白剂量。研究团队首次利用该系统精确调控哺乳类的多种内源基因,并结合hESC神经分化系统诱导出了小头畸形和GABA中间神经元发育障碍等表型,有效模拟了FOXG1综合征。更重要的是,团队发现了FOXG1的两个剂量临界值,低于60%会导致脑腹侧形成障碍和GABA中间神经元发育延迟,30%以下则无法形成腹侧端脑及GABA中间神经元。上述发现为我们深入了解FOXG1综合征患者表型多样性,建立新的治疗策略奠定了重要基础。
本研究于2019年2月25日在线发表于国际学术刊物Nature Communications上。该研究工作由中国科学院动物研究所和中国科学院干细胞与再生医学创新研究院完成。博士生朱文亮、张博雅以及硕士生李梦琦为论文的共同第一作者,胡宝洋研究员、李伟研究员与周琪研究员为论文的共同通讯作者。上述研究得到了中国科学院重点部署项目、国家自然科学基金以及北京市科技重大专项等项目的支持。(DOI:10.1038/s41467-019-08841-7) (论文链接)
人多能干细胞中蛋白精确调控系统

