生物钟的调控机制在不同物种中高度保守,它使哺乳动物的生理和行为呈现出与外界24小时昼夜循环一致的节律性变化,从而维持机体组织和细胞生理活动的动态平衡。越来越多的证据显示,节律调控的失衡与衰老密切相关。研究表明,成体干细胞的衰老和耗竭是个体衰老的重要标志之一,也是引发人类退行性疾病(如退行性关节病变)的关键驱动力。然而,核心节律蛋白在人类成体干细胞衰老过程中的调控作用尚不明确,能否通过靶向核心节律蛋白来延缓衰老或者防治衰老相关疾病也有待探索。
2020年7月31日,中国科学院动物研究所刘光慧研究组、曲静研究组和中国科学院北京基因组研究所张维绮研究组合作在Cell Research杂志在线发表题为“Stabilization of heterochromatin by CLOCK promotes stem cell rejuvenation and cartilage regeneration”的研究论文。该研究首次揭示了核心节律蛋白CLOCK具有拮抗人干细胞衰老的新型功能。此外,研究发现基于CLOCK过表达的基因治疗可以有效缓解增龄性小鼠骨关节变性并促进关节软骨再生,为延缓人类衰老、防治衰老相关退行性疾病提供新的思路和潜在的干预靶标。
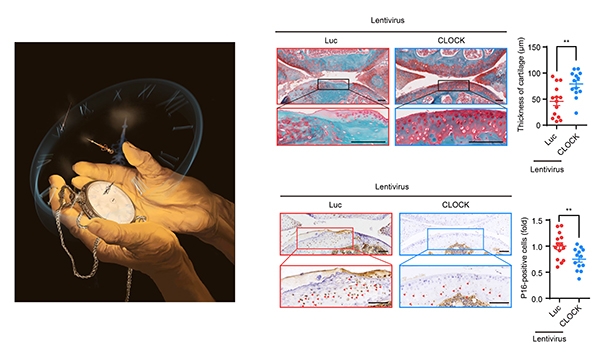
图. CLOCK通过稳定异染色质延缓人干细胞衰老并促进老年动物关节软骨再生
CLOCK是生物钟的核心组成成分之一,作为转录因子在维持细胞分子生物钟和个体节律方面发挥着重要作用,但其在细胞衰老过程中的调控作用尚不明确。在该研究中,研究人员发现CLOCK在复制性衰老、生理性衰老以及儿童早衰症的多种人间充质干细胞模型中均呈现下调表达。进而,研究人员利用CRISPR/Cas9介导的基因编辑技术和干细胞定向分化技术获得了CLOCK蛋白缺失的人间充质干细胞,并发现CLOCK蛋白的缺失导致人间充质干细胞出现加速衰老的表型。深入的机制研究表明,CLOCK能与核纤层及异染色质蛋白形成复合物,共同维持基因组重复元件区域异染色质结构的稳定、抑制重复元件的转录本表达,进而维持表观基因组的稳定并抵御人间充质干细胞的衰老。此外,研究表明过表达野生型CLOCK 或其转录激活功能缺失的突变体均可延缓细胞衰老,提示其发挥延缓细胞衰老作用的机制不依赖于经典的转录活性。研究人员还发现CLOCK在老年小鼠骨关节中表达量下调,而关节腔注射CLOCK慢病毒表达载体可以降低衰老细胞的比例,抑制炎症反应并刺激软骨的再生,进而缓解增龄相关的骨关节退行,改善老年个体的运动能力。
该研究首次揭示了核心节律蛋白CLOCK调控人干细胞衰老的新功能与新机制。这一研究成果不仅拓展了人们对核心节律蛋白新型生物学功能的认识,也加深了人们对衰老的表观遗传调控机制的理解,同时为衰老的转化医学研究开拓了思路。
该研究工作由中国科学院动物研究所、中国科学院北京基因组研究所、中国科学院干细胞与再生创新研究院、首都医科大学宣武医院、北京医院等多家机构合作完成。中国科学院动物研究所刘光慧研究员和曲静研究员、以及中国科学院北京基因组研究所张维绮研究员为文章的共同通讯作者。中国科学院动物研究所博士研究生梁楚倩和刘尊鹏、以及宋默识研究员为并列第一作者。该研究得到了周琪院士、孙亮教授、陈彪教授、蔡彦宁教授、张二荃教授的指导与支持,同时获得了国家科技部、国家自然科学基金委、中国科学院及北京市等项目的资助。
文章链接:https://www.nature.com/articles/s41422-020-0385-7

