哺乳动物妊娠期间,母亲和胎儿健康的决定因素之一在于二者之间营养物质的适当分配。胎盘作为母-胎之间的桥梁,在感知胎儿营养需求、协调母体营养供应以及自身营养输送能力等方面发挥关键作用。胎盘发育不完善将引起一系列复杂的妊娠相关疾病,如子痫前期、复发流产、胎儿生长受限等,对母儿近远期健康都造成严重危害。然而迄今,对人类胎盘的认知依然是个“黑匣子”,其发育调控机理及其介导的妊娠适应性调节机制仍有待阐明,而与之密切相关的妊娠重大疾病的预测、防治和干预也亟待突破。
滋养层细胞是胎盘的主要组分,其中单核的细胞滋养层细胞(Cytotrophoblast,CTB)经细胞融合形成多核的合体滋养层(Syncytiotrophoblast,STB),这一细胞分化过程被称为合体化。STB位于胎盘外表面,直接与母血相接触,是母-胎之间物质交换的主体。STB是迄今已知的人体中最大的多核上皮细胞,但胎盘中为何要形成如此巨大的多核细胞,对母-胎间物质交换有何生理优势,仍是悬而未决的科学问题。
2021年1月6日, PNAS杂志在线发表了来自中国科学院动物研究所王雁玲研究组的研究论文“Placental trophoblast syncytialization potentiates macropinocytosis via mTOR signaling to adapt to reduced amino acid supply”。该工作在多种人类胎盘滋养层细胞合体化模型、小鼠模型和人类胎儿发育迟缓(FGR)临床病例中开展综合研究,揭示了胎盘合体滋养层细胞在分化过程中通过独特的巨胞饮(macropinocytosis)途径进行营养物质的高效率母胎转运,在mTOR信号调节下感知母体营养状况,并通过增强合体化和巨胞饮的方式补偿母体营养供应不足,保障胎儿发育的需求。该研究成果对认识人类胎盘发育和功能有重大推进,并为挖掘FGR的潜在治疗策略提供了科学依据。
研究人员首先利用多种滋养层体外分化的细胞模型,发现合体化激发了独特的巨胞饮功能,吞噬环境中的大分子物质作为替代营养供应。进而利用氨基酸饥饿模型,证明氨基酸缺乏能够促进滋养层细胞合体化,进而极大地增强其巨胞饮能力;在这一过程中,mTOR信号通路的抑制是滋养层细胞感知营养压力和刺激分化的关键途径。
进而发现,在小鼠胎盘合体化的关键阶段给予雷帕霉素(Rapamycin,Rapa)处理以模拟氨基酸缺乏导致的mTOR信号通路受抑,能够使其胎盘滋养层合体化增强,表现为MCT1和MCT4分子阳性的两层STB(Syn I和Syn II)增厚,合体化相关分子表达增强;同时,电镜结果证实了Rapa处理小鼠胎盘的STB中有大量的巨胞饮囊泡,小鼠胎盘中荧光标记大分子量葡聚糖的信号显著累积,表明其具备了强大的巨胞饮能力。与此同时给予巨胞饮特异性抑制剂EIPA处理后,胎儿和胎盘的重量显著降低,胎鼠表现为极显著的胎儿发育迟缓FGR表型。与之相应的是,临床上典型FGR患者的胎盘中,mTOR信号受抑制,滋养层过度合体化且巨胞饮能力增强。
上述结果揭示了胎盘形成多核STB的一个重要生理意义,即伴随合体化获取独特的摄取大分子营养物质的能力—巨胞饮;当遭遇环境营养不足时,藉此摄取母血中的蛋白质作为氨基酸替代来源,积极补偿环境营养短缺以保证胎儿持续生长的需求。因此,滋养层细胞合体化是胎盘应对营养压力的重要妊娠适应性环节。
该研究由中国科学院动物研究所、美国匹兹堡大学和厦门大学等单位合作完成。中国科学院动物研究所助理研究员邵璇博士、北京朝阳医院曹广明博士和广州医科大学附属第三医院陈敦金教授为本文共同第一作者,中国科学院动物研究所王雁玲研究员、美国匹兹堡大学Yoel Sadvosky教授和厦门大学曹彬教授为论文的共同通讯作者。该研究得到了国家重点研发计划(2018YFC1004100、2016YFC1000200、2018YFC1004400等)、国家自然科学基金项目(81730040、81971414、31800986)和福建省自然科学基金项目(2020J06003)的资助。
文章链接:https://www.pnas.org/content/118/3/e2017092118
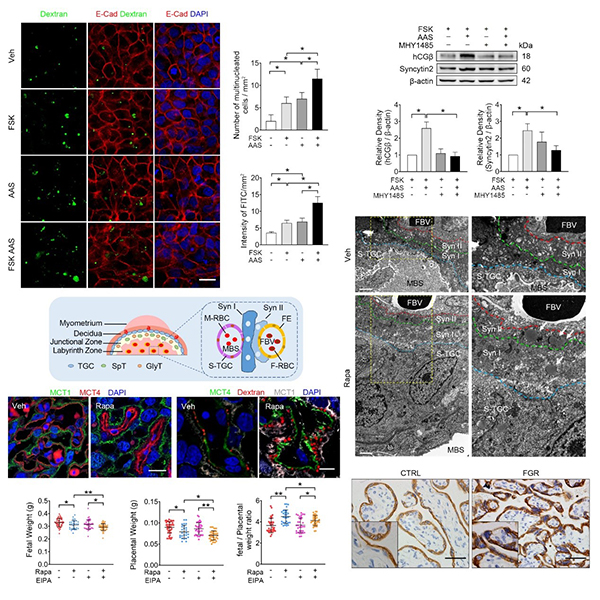
图1. mTOR信号通路失活是滋养层细胞增强合体化和激发巨胞饮的关键途径

图2. mTOR介导的胎盘合体滋养层感知和应对环境营养状况的机制模式图

