T细胞在抗原的持续刺激下会逐渐丧失对肿瘤细胞的杀伤能力,同时伴随着多种抑制性受体的上调,增殖分化能力的下降,转录组和表观遗传组的重塑等,这种现象被称为T细胞耗竭。T细胞耗竭最初在慢性病毒感染环境中发现,后来在肿瘤病人中也发现了这一现象。T细胞耗竭是CAR-T等T细胞免疫疗法攻克实体肿瘤的主要障碍之一,进一步理解和调控这一过程是提高基于T细胞的免疫治疗临床效果的关键。
2022年10月13日,中国科学院动物研究所、干细胞与生殖生物学国家重点实验室、北京干细胞与再生医学研究院王皓毅团队在Cancer Cell上发表题为Depletion of BATF in CAR-T cells enhances antitumor activity by inducing resistance against exhaustion and formation of central memory cells的最新研究成果。首先,为了更好的研究T细胞耗竭过程与机制,该研究通过降低CAR-T细胞与肿瘤细胞的比例并延长共培养,在体外获得具有典型耗竭特征的人原代CAR-T细胞耗竭模型。为了发现新的T细胞耗竭调控因子,该研究基于这一模型进行了候选基因的筛选,发现敲除转录因子BATF可以显著提高CAR-T细胞的体内、外抗肿瘤活性。后续的机制研究中发现,BATF直接靶向结合耗竭相关的多个关键基因并上调其表达,同时BATF靶向并调控效应及记忆T细胞相关基因的表达。因此,敲除BATF在提高CAR-T细胞抵抗耗竭能力的同时使得CAR-T细胞产生更多的中央记忆细胞亚群,进而提高了CAR-T细胞治疗实体瘤的效果。
近年来,已有多项研究表明多种转录因子参与调控T细胞耗竭过程,如TOX,NR4A,c-jun等。对于转录因子BATF,其在T细胞耗竭中的作用颇有争议,在以往的研究中报道了不同的结论。一方面,有研究称PD-1通过上调BATF的表达而导致T细胞耗竭,也有研究表明CAR-T细胞敲除BATF提高了效应因子IL-2及IFNγ的分泌;而另一方面,有研究发现BATF的缺失降低了T细胞分泌IFNγ及增殖的能力。同时,也有研究认为BATF可以阻断CAR-T细胞的耗竭,过表达BATF使CAR-T细胞具有更强的增值能力和肿瘤杀伤能力,并产生长期的肿瘤抑制效果。这些看似相反的结论,使团队更加有兴趣去解析清楚BATF到底是如何调控T细胞耗竭的。
为了进一步验证BATF的功能,该研究进行了更为深入细致的研究。通过在人的6种不同CAR-T细胞及小鼠的OT-1 T细胞中进行BATF的敲除和过表达,在不同耗竭诱导的条件下,该研究均发现BATF敲除可以提高CAR-T/OT-1 T细胞抗肿瘤活性,而BATF过表达则降低了CAR-T/OT-1 T细胞的杀伤能力。进一步分析发现BATF在不同的CAR-T细胞耗竭情况下发挥的作用是不同的,随着耗竭程度的加深(效靶比的降低或者肿瘤刺激轮次的增加),BATF对CAR-T细胞功能的影响越来越显著。同时该研究也发现BATF直接结合和上调一系列与细胞增殖有关的基因,因此,在非耗竭的实验条件下,BATF的过表达可以促进T细胞增殖,因此在整体上增强了其功能。但是在引发T细胞严重耗竭的实验条件下,BATF促进耗竭的功能就起了主导作用。因此,该研究的数据很好的说明了为什么前期的研究会得出关于BATF功能相反的结论。
作为一个转录调控因子,该研究表明BATF特异性的结合在T细胞耗竭、增殖、以及亚型分化相关的基因上并调控其表达,体现出多方面的功能。基因总是在与其作用环境相互作用中发挥功能的,因此当研究和阐释一个基因的功能的时候,选择不同的实验条件很可能会得出不同的结论。该研究认为,在大多数情况下浸润至肿瘤的CAR-T细胞会处于耗竭的状态,因此该研究建立的人原代CAR-T细胞体外耗竭模型是研究耗竭相关基因功能和机制的理想工具。
综上所述,研究发现转录因子BATF在CAR-T细胞耗竭过程中发挥着重要作用,敲除BATF可以提高CAR-T细胞的抗耗竭能力及形成中央记忆细胞的能力,从而产生持久有效的抗肿瘤效果。BATF缺失的CAR-T细胞在未来的临床应用中具有持久性和有效性的优势。
中国科学院动物研究所博士研究生张兴颖,张晨泽及硕士研究生乔苗苗为论文共同第一作者。中国科学院动物研究所、干细胞与生殖生物学国家重点实验室、北京干细胞与再生医学研究院王皓毅研究员为本文的通讯作者。

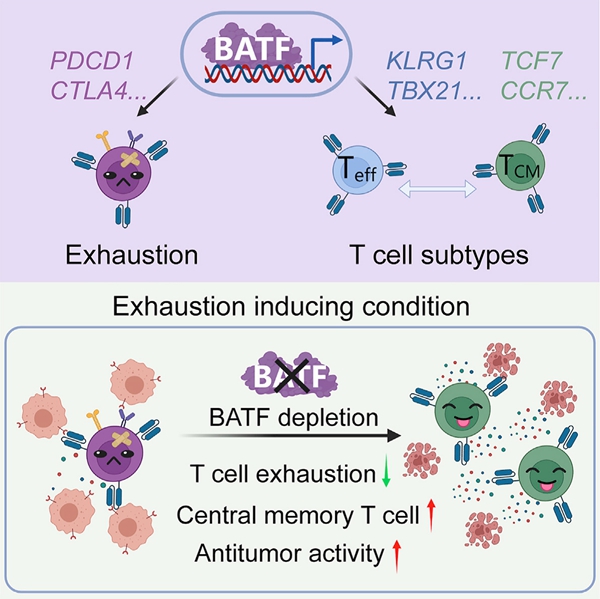
图1 BATF在CAR-T细胞耗竭诱导条件下的功能
原文链接:https://doi.org/10.1016/j.ccell.2022.09.013

