|
哺乳动物的性腺是由生殖细胞和体细胞两类细胞组成的,原始生殖细胞(PGC)来源于胚胎发育早期的上胚层,然后经过定向迁移到达生殖嵴(Genital ridge),与生殖嵴体细胞共同发育为性腺。哺乳动物的性别决定发生在原始生殖细胞完成迁移以后,生殖嵴的体细胞在性别决定和性别分化过程中发挥重要作用。随着性别决定的完成,生殖细胞的命运也会发生了改变。在雄性个体中生殖细胞处于静止期,直到出生后才重新启动减数分裂过程;而雌性生殖细胞在性别完成之后立刻启动减数分裂过程。性别分化是一个受多种因素精细调控的复杂过程,特别是体细胞与生殖细胞之间的相互作用发挥关键作用。性腺发育早期出现异常在临床上会导致生殖细胞肿瘤、性腺分化异常和性别逆转等疾病。我们研究组主要是利用基因敲除的小鼠模型和细胞生物学的方法研究在性别分化过程中体细胞分化的调控机制,以及体细胞与生殖细胞相会作用对生殖细胞发育命运的调控。

Wt1 是睾丸支持细胞谱系维持的关键基因, 缺失Wt1后睾丸支持细胞转分化为分泌雄激素的间质细胞
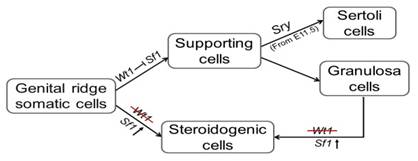
在性腺发育过程中支持类体细胞与激素合成细胞来源于未分化性腺的体细胞,敲除Wt1后,睾丸支持细胞和卵巢颗粒细胞都不能分化,未分化性腺的体细胞都发育为激素合成细胞,性别分化过程不能完成
|
研究内容和目标:
1. 性别分化过程中性腺体细胞的分化调控。支持类体细胞(睾丸支持细胞和卵巢颗粒细胞)和激素合成细胞(睾丸间质细胞和卵巢膜间质细胞)是哺乳动物性腺中两类主要的体细胞。但是这两类细胞的分化是如何调控的,目前还没有明确结论 。我们的研究首次证明这两类细胞都来源于未分化性腺的体细胞, 而它们之间的分化受Wt1基因调控。我们将进一步利用基因敲除的小鼠模型和体外培养系统,深入研究调控性腺体细胞分化的分子机制。
2. 生殖细胞减数分裂启动调控。减数分裂 是生殖细胞也有的一种细胞分裂方式,是单倍体配子形成的 关键环节。在卵巢中,生殖细胞在性别决定完成后,立刻启动减数分裂过程。而雄性生殖细胞在性别决定后处于静止期,直到出生后才重新启动减数分裂过程。以前的研究发现几个在减数分裂启动过程中发挥关键功能的基因, 但是对于减数分裂启动调控的分子调控机制, 目前的了解还非常有限。我们的研究发现了几个在减数分列启动过程中发挥作用的基因。下一步利用动物模型和生物化学的方法对它们的作用机理进行系统研究。
代表性发表论文:
- Zhang L, Chen M, Wen Q, Li Y, Wang Y, Wang Y, Qin Y, Cui X, Yang L, Huff V, *Gao F. Reprogramming of Sertoli cells to fetal-like Leydig cells by Wt1 ablation. Proc Natl Acad Sci U S A. 2015;112(13):4003-8.
- Wang Y, Zhu T, Li Q, Liu C, Han F, Chen M, Zhang L, Cui X, Qin Y, Bao S, *Gao F. Prmt5 is required for germ cell survival during spermatogenesis in mice. Scientific Reports. 2015; 5:11031.
- Gao F*§, Zhang J§, Wang XN, Yang JL, Chen DH, Huff V, Liu YX*. Wt1 functions in ovarian follicle development by regulating granulosa cell differentiation. Human Molecular Genetics. 2014, Jan 15;23(2):333-41.
- Wang XN, Li Z, Ren Y, Jiang T, Wang YQ, Chen M, Zhang J2, Hao JX, Wang YB, Sha RN, Huang Y, Liu X, Hu JC, Sun GQ, Li HG, Xiong CL, Xie J, Jiang ZM, Cai ZM, Wang J, Wang J, Huff V*, Gui YT*, Gao F*. The Wilms Tumor Gene, Wt1, Is Critical for Mouse Spermatogenesis via Regulation of Sertoli Cell Polarity and Is Associated with Non-Obstructive Azoospermia in Humans. PLoS Genetics. 2013, Volume 9, Issue 8, e1003645.
- Chen SR., Zheng QS., Zhang Y., Gao F*., Liu YX*. (2013) Disruption of genital ridge development causes aberrant primordial germ cell proliferation but does not affect their directional migration. BMC Biol. 11(1): 22. (*Co-corresponding author)
- Hu QH *., Gao F*., Tian WH., Ruteshouser C., Wang YQ., Lazar A., Stewart J., Strong LC., Behringer RR., and Huff V. (2011) Wt1 Ablation and Igf2-Up-regulation in Mice Result in Wilms Tumors with Activated pERK1/2. Journal of Clinical Investigation. 121(1): 174–183 (*Equal contribution)
- Chang H*., Gao F*., Guillou F., Taketo MM., Huff V., Behringer RR. (2008) Wt1 negatively regulates (beta)-Catenin Signaling during testis development. Development. 135(10):1875-1885. (*Equal contribution)
- Gao F., Maiti S., Alam N., Zhang Z., Deng JM., Behringer RR., Lécureuil C., Guillou F., Huff V. (2006) Wt1 is Required for Sox9 Expression and Normal Tubular Architecture in the Developing Testes. ProcNatlAcadSci U S A.103(32):11987-92
- Gao F., Maiti S., Sun GZ., Huff V. (2004) Mouse WT1 missense mutation results in glomerulosclerosis characteristic of human Denys-Drash Syndrome. Molecular Cellular Biology. 24(22):9899-910
- Gao F., Shi HY., Daughty C., Cella N., Zhang M. (2004) Maspin plays an essential role in early embryonic development. Development. 131:1479-1489

|

