| 再生医学、衰老与癌症是目前生物学研究的前沿领域,是与人类健康息息相关、具有巨大的临床应用价值的三个科学议题。这三个生物学研究领域之间相互关联,往往存在着共通的调控机制以及相似的问题本质。而发育生物学及干细胞生物学研究可以作为研究以上三个问题的基础。干细胞作为再生医学 的核心研究对象具有巨大的基础研究和临床应用价值,但是在具体转化应用上如何利用干细胞形成具有功能的组织单位进而构建具有 生理功能的“组织器官”并参与到机体中行使功能,依然是亟待解 决的主要挑战。而伴随着动物个体生长,成体干细胞的数量及功能 逐渐下降,导致机体组织不断出现功能减退,干细胞耗竭也是衰老的重要原因以及标志。因此对于成体干细胞参与组织结构及功能维持的研究,不仅可以作为组织工程领域的突破,同时也可以为机体衰老研究提供 分子机制研究的基础。 另一方面,在DNA序列突变以及表观遗传变化的双重作用下“ 误入歧途”的成体干细胞经过一系列的转变而发展成为恶性增殖细胞,是肿瘤或癌症发生的重要源头之一。更进一步,癌症恶化转移的过程中往往会异常激活的,在正常发育过程中存在的表观遗传程式来获得转移及抗药等恶性性状。其中胚胎发育过程中出现的“上皮间质转化(EMT)”不仅在损伤修复中参与成体上皮细胞激活从而对伤口进行迁移修复更是参与肿瘤转移的重要机制。目前 ,越来越多的研究已经集中在生理条件下干细胞与组织微环境的相互作用,参与维持成体组织器官功能继而参与调控机体衰老或形成 肿瘤的过程及机制。成体干细胞的干细胞微环境会 成为游离肿瘤细胞的“休眠微环境”,而这些成体干细胞微环境 如何调控游离肿瘤细胞休眠以及激活复发不仅已经成为癌症领域的 研究热点之一同时也是临床应用方面亟待解决的挑战。 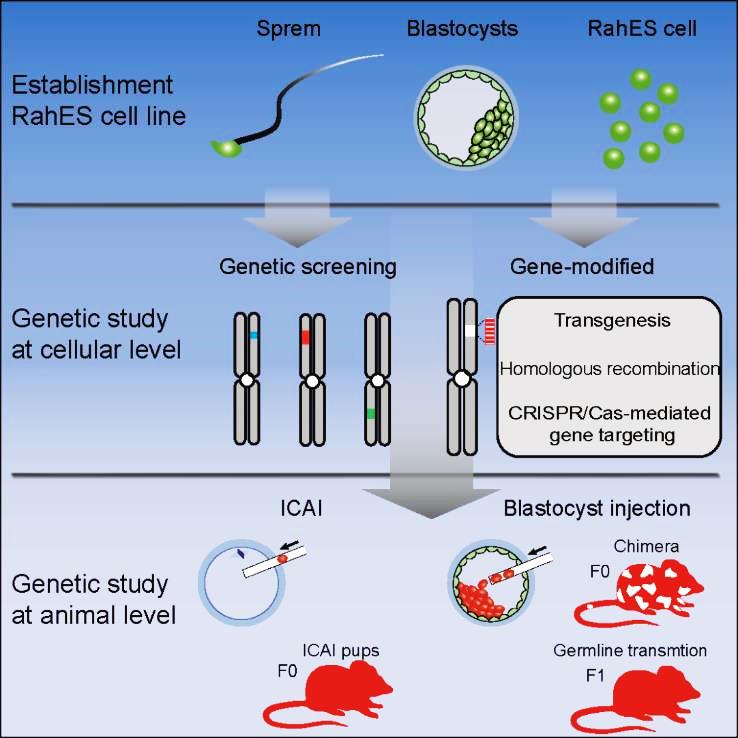
大鼠单倍体胚胎干细胞的建立以及应用 Cell Stem Cell 2014
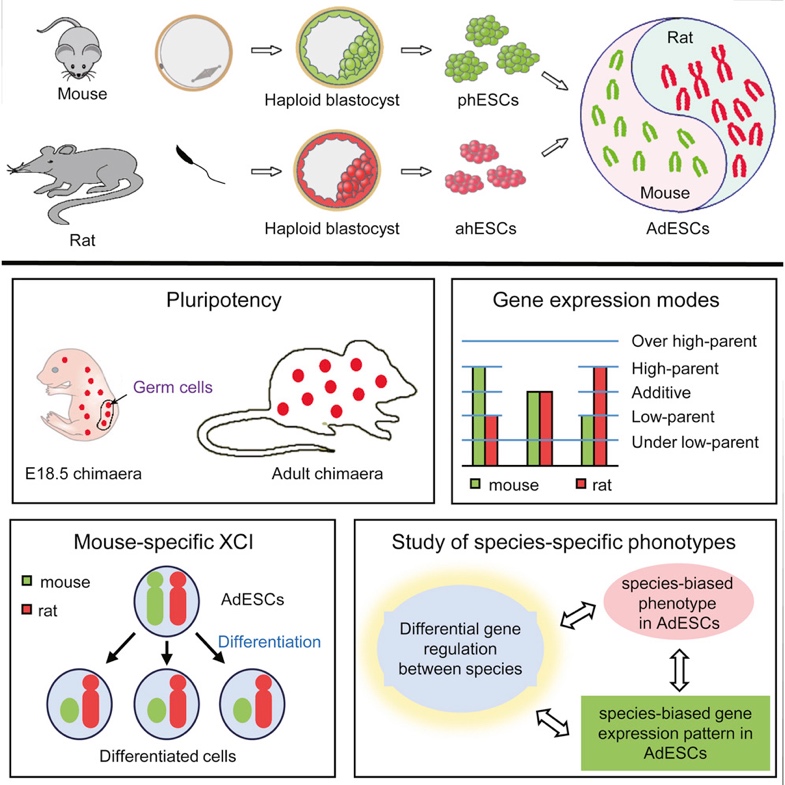
大小鼠异源二倍体胚胎干细胞的建立及应用 Cell 2016
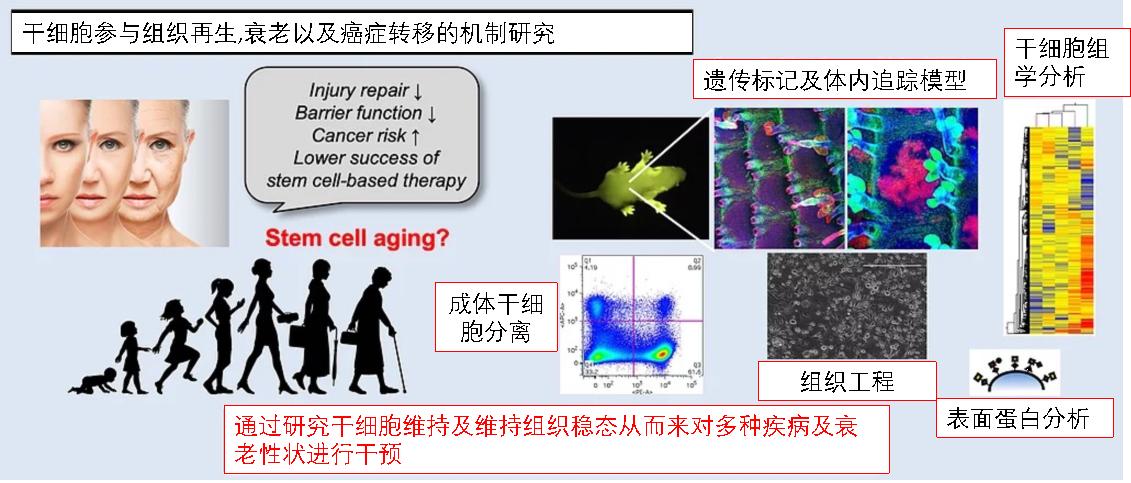
未来研究方向
| 研究内容和目标:
本研究组将聚焦干细胞如何协调其细胞内表观遗传修饰、细胞极性、细胞粘附和细胞骨架等动态变化来响应来自不同组织微环境的各种复杂信号从而参与调控正常组织发育、组织稳态平衡,损伤修复以及癌症产生与转移等过程。我们将广泛应用各种细胞、分子和发育生物学技术来阐明组织发育以及组织稳态下干细胞的精细动态变化并为我们进一步了解并干预组织衰老,损伤修复和癌症产生及转移建立基础。 代表性发表论文: - Guihai Feng, Xin Qin, Jiahao Zhang, Wuliang Huang, et al., Xin Li*. CellPolaris: Decoding Cell Fate through Generalization Transfer Learning of Gene Regulatory Networks. bioRxiv (2023).
- Xiaodong Yang, Guole Liu, Guihai Feng, Dechao Bu, Pengfei Wang, Jie Jiang, et al., Xin Li*. GeneCompass: Deciphering Universal Gene Regulatory Mechanisms with Knowledge-Informed Cross-Species Foundation Model. bioRxiv (2023).
- Yun Zhang, Joana Liu Donaher, Sunny Das, Xin Li, et al., Genome-wide CRISPR screen identifies PRC2 and KMT2D-COMPASS as regulators of distinct EMT trajectories that contribute differentially to metastasis. Nat Cell Biol (2022).
- Li X, Wang J, Wang L, Gao Y, Feng G, Li G, Zou J, Yu M, Li YF, Liu C, Yuan XW, Zhao L, Ouyang H, Zhu JK, Li W, Zhou Q, Zhang K. Lipid metabolism dysfunction induced by age-dependent DNA methylation accelerates aging. Signal Transduct Target Ther (2022).
- Li X, Wang J, Wang L, Feng G, Li G, Yu M, Li Y, Liu C, Yuan X, Zang G, Li Z, Zhao L, Ouyang H, Quan Q, Wang G, Zhang C, Li O, Xiang J, Zhu JK, Li W, Zhou Q, Zhang K. Impaired lipid metabolism by age-dependent DNA methylation alterations accelerates aging. Proc Natl Acad Sci USA (2020).
- Xia HM*, Li Xin*, Gao WW*, Fu X, Ronnie H. Fang, Zhang LF, Zhang Kang. Tissue repair and regeneration with endogenous stem cells. Nat Rev Mater (2018).
- Zhang Y*, Zhang X*, Shi J*, Tuorto F*, Li Xin*, Liu Y, Liebers R, Zhang L, Qu Y, Qian J, Pahima M, Liu Y, Yan M, Cao Z, Lei X, Cao Y, Peng H, Liu S, Wang Y, Zheng H, Woolsey R, Quilici D, Zhai Q, Li L, Zhou T, Yan W, Lyko F, Zhang Y, Zhou Q, Duan E, Chen Q. Dnmt2 mediates intergenerational transmission of paternally acquired metabolic disorders through sperm small non-coding RNAs. Nature Cell Biology (2018).
- Li Xin*, Cui XL*, Wang JQ*, Wang YK, Li YF, Wang LY, Wan HF, Li TD, Feng GH, Shuai L, Li ZK, Gu Q, Hao J, Wang L, Zhao XY, Liu ZH, Wang XJ, Li W*, Zhou Q*. Generation and application of mouse-rat allodiploid embryonic stem cells. Cell (2016).
- Wang JQ*, Li Xin*, Wang L*, Li J, Zhao Y, Bou G, Li Y, Jiao G, Shen X, Wei R, Liu S, Xie B, Lei L, Li W, Zhou Q, Liu Z. A novel long intergenic noncoding RNA indispensable for the cleavage of mouse two-cell embryos. EMBO Rep (2016).
- Chen Q*, Yan M*, Cao Z*, Li Xin*, Zhang Y*, Shi J*, Feng GH, Peng H, Zhang X, Zhang Y, Qian J, Duan E#, Zhai Q, Zhou Q. Sperm tsRNAs contribute to intergenerational inheritance of an acquired metabolic disorder. Science (2016).
- Li Xin*, Wang J.*, Wang L.*, Wan H., Li Y., Li TD., Wang Y., Shuai L., Mao Y., Cui X., Wang L., Liu Z., Zhou Q. Co-participation of paternal and maternal genomes before blastocyst stage is not required for full-term development of mouse embryos. Journal of Molecular Cell Biology (2015).
- Wang J*, Li Xin*, Zhao Y., Li J., Zhou Q., and Liu Z. (2015). Generation of cell-type-specific gene mutations by expressing the sgRNA of the CRISPR system from the RNA polymerase II promoters. Protein & cell (2015).
- Shi J.*, Chen Q.*, Li Xin*, Zheng X.*, Zhang Y.*, Qiao J., Tang F., Tao Y., Zhou Q., and Duan E. Dynamic transcriptional symmetry-breaking in pre-implantation mammalian embryo development revealed by single-cell RNA-seq. Development (2015).
- Li Wei*, Li Xin*, Li TD*, Jiang MG*, Wan H, Luo GZ, Feng C, Cui X, Teng F, Yuan Y, Zhou Q, Gu Q, Shuai L, Sha J, Xiao Y, Wang L, Liu Z, Wang XJ, Zhao XY, Zhou Q. Genetic modification and screening in rat using haploid embryonic stem cells. Cell Stem Cell (2014).
- Li Xin*, Xia BL*, Li W, Zhou Q. Assessing reprogramming by chimera formation and Tetraploid complementation. Methods Mol Biol (2014).
|

