| 研究组从事的主要研究方向包括:生殖、发育、干细胞的基础研究,并致力于推动再生医学和干细胞的转化应用。 研究组针对不同物种建立了稳定的体细胞核移植及iPS等不同体细胞重编程技术平台,证明iPS细胞具有发育为健康小鼠的能力,与胚胎干细胞具有相似的多能性;针对同胚层及跨胚层转分化开展了一系列研究,并依托一系列技术平台尝试深入发掘体细胞去分化及转分化机制,阐明细胞命运转换过程中发生事件及关键因子,首次发现并明确证实决定小鼠(哺乳动物)干细胞多能性的关键基因决定簇,并对其调控机制进行了探索;证明iPS细胞来源的小鼠具有与胚胎干细胞来源小鼠相同的生理功能但具有致瘤倾向性;探索了哺乳动物单倍体干细胞的建立及其在生殖发育和遗传修饰等方面的应用,利用基因修饰的单倍体胚胎干细胞开展了大鼠的遗传筛选,并成功获得转基因小鼠和大鼠,为哺乳动物的生殖和遗传学研究提供了新的重要工具;首次创建了新型的异种杂合二倍体胚胎干细胞,为研究进化上不同物种间性状差异的分子机制和X染色体失活提供了新型的有利工具;结合单倍体干细胞和基因编辑技术,首次获得了表型正常的孤雌小鼠,首次获得具有两个父系基因组的到期发育孤雄小鼠;首次将第一次细胞命运分化的选择推到了2-细胞胚胎时期,为探索早期胚胎的全能性调控以及第一次细胞命运分化机理奠定重要基础,也为研究早期胚胎中内源逆转录病毒序列和长非编码RNA的功能提供了新的思路;发现修复基因印记异常可大幅提高动物克隆效率;建立了包括小鼠、大鼠、猪和灵长类在内多个物种的基因修饰体系,包括建立具有种系嵌合能力的大鼠胚胎干细胞系,利用CRISPR-Cas基因修饰系统实现大鼠多基因的快速同时敲除;将CRISPR技术和胚胎注射相结合不用杂交交配直接一步获得基因敲除猪和猴模型,为疾病动物模型的制备提供了重要基础。 国家干细胞资源库(原北京干细胞库)通过CNAS生物样本库ISO20387国际标准认可的现场评审工作,建立并储存了一批获得中国食品药品检定研究院质量复核的临床级胚胎干细胞系和多种功能细胞,进一步对所获得的功能细胞进行了安全性和有效性非临床研究。在国内率先启动了世界首批基于配型开展的干细胞治疗帕金森病、老年黄斑变性的临床研究,是国家首批备案的2个项目,目前正在开展国家两委备案的多个干细胞临床研究项目。自2020年7月起,国家干细胞资源库成为中国科学院动物研究所的一个独立科研部门。 
证明了iPS细胞具有胚胎干细胞一样的全能性,即发育成完整个体的能力
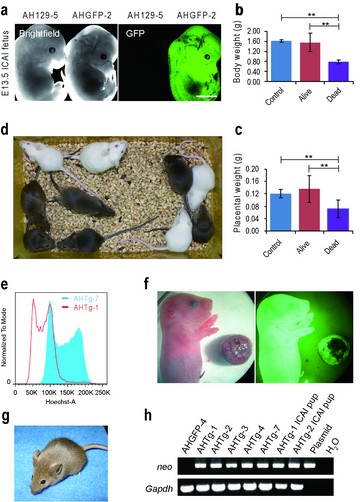
利用孤雄单倍体胚胎干细胞,通过卵胞质注射产生转基因小鼠,表明孤雄单倍体胚胎干细胞具有发育多能性,为快速建立隐性基因动物模型及辅助生殖提供了新方法
创造出新型的异种杂合二倍体胚胎干细胞,为研究进化上不同物种间性状差异的分子机制和X染色体失活提供了新型的有利工具
双雌生殖的小鼠及其后代
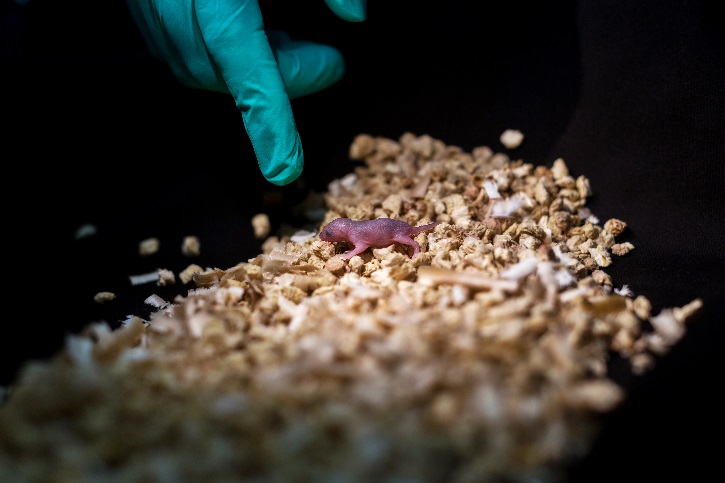
双雄生殖的小鼠
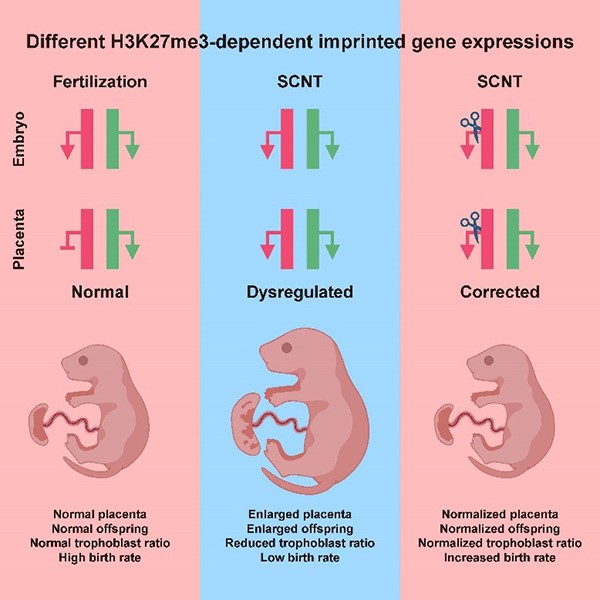
修复H3K27me3印记异常能提高克隆效率、改善克隆小鼠和克隆胎盘的发育表型
| 研究内容和目标:
我组主要从事生殖、发育、干细胞的基础研究,并致力于推动再生医学和干细胞的转化应用。 代表性发表论文: - Wang LB#, Li ZK#, Wang LY#, Xu K#, Ji TT#, Mao YH, Ma SN, Liu T, Tu CF, Zhao Q, Fan XN, Liu C, Wang LY, Shu YJ, Yang N, Zhou Q*, Li W*. A sustainable mouse karyotype created by programmed chromosome fusion. (2022) Science 377(6609):967-975. doi: 10.1126/science.abm1964.
- Wang LY#, Li ZK#, Wang LB#, Liu C#, Sun XH, Feng GH, Wang JQ, Li YF, Qiao LY, Nie H, Jiang LY, Sun H, Xie YL, Ma SN, Wan HF, Lu FL*, Li W*, Zhou Q*. Overcoming Intrinsic H3K27me3 Imprinting Barriers Improves Post-implantation Development after Somatic Cell Nuclear Transfer. (2020) Cell Stem Cell 27(2):315-325.e5. doi: 10.1016/j.stem.2020.05.014.
- Wang J#, Wang L#, Feng G#, Wang Y#, Li Y, Li X, Liu C, Jiao G, Huang C, Shi J, Zhou T, Chen Q, Liu Z, Li W*, Zhou Q*. Asymmetric Expression of LincGET Biases Cell Fate in Two-Cell Mouse Embryos. (2018) Cell 175(7):1887-1901.e18. doi: 10.1016/j.cell.2018.11.039.
- Li ZK#, Wang LY#, Wang LB#, Feng GH#, Yuan XW#, Liu C, Xu K, Li YH, Wan HF, Zhang Y, Li YF, Li X, Li W*, Zhou Q*, Hu BY*. Generation of Bimaternal and Bipaternal Mice from Hypomethylated Haploid ESCs with Imprinting Region Deletions. (2018) Cell Stem Cell 23(5):665-676.e4. doi: 10.1016/j.stem.2018.09.004.
- Li X#, Cui XL#, Wang JQ #, Wang YK, Li YF, Wang LY, Wan HF, Li TD, Feng GH, Shuai L, Li ZK, Gu Q, Hao J, Wang L, Zhao XY, Liu ZH, Wang XJ, Li W*, Zhou Q*. Generation and Application of Mouse-Rat Allodiploid Embryonic Stem Cells. (2016) Cell 164(1–2): 279–292. doi: 10.1016/j.cell.2015.11.035.
- Zhou Q#, Wang M#, Yuan Y#, Wang X, Fu R, Wan H, Xie M, Liu M, Guo X, Zheng Y, Feng G, Shi Q, Zhao XY*, Sha J*, Zhou Q*. Complete Meiosis from Embryonic Stem Cell-Derived Germ Cells In Vitro. (2016) Cell Stem Cell 18(3):330-340. doi: 10.1016/j.stem.2016.01.017.
- Wan HF#, Feng CJ#, Teng F#, Yang SH#, Hu BY, Niu YY, Xiang P, Fang WZ, Ji WZ, LI W*, Zhao XY*, Zhou Q*. One-step generation of p53 gene biallelic mutant Cynomolgus monkey via the CRISPR/Cas system. (2015) Cell Research 25(2):258-261. doi: 10.1038/cr.2014.158.
- Li W#, Li X#, Li TD#, Jiang MG#, Wan HF, Luo GZ, Feng CJ, Cui XL, Teng F, Yuan Y, Zhou Q, Gu Q, Shuai L, Sha JH, Xiao YM, Wang L, Liu ZH, Wang XJ, Zhao XY, Zhou Q*. Genetic modification and screening in the rat using haploid embryonic stem cells. (2014) Cell Stem Cell 14(3):404-414. doi: 10.1016/j.stem.2013.11.016.
- Li W, Teng F, Li TD, Zhou Q*. Simultaneous generation and germline transmission of multiple gene mutations in rat using CRISPR-Cas systems. (2013) Nat Biotechnol. 31(8):684-686. doi: 10.1038/nbt.2652.
- Li W#, Shuai L#, Wan HF#, Dong MZ#, Wang M, Sang LS, Feng CJ, Luo GZ, Li TD, Li X, Wang LB, Zheng QY, Sheng C, Wu HJ, Liu ZH, Liu L, Wang L, Wang XJ, Zhao XY*, Zhou Q*. Androgenetic haploid embryonic stem cells produce live transgenic mice. (2012) Nature 490(7420):407-411. doi: 10.1038/nature11435.
- Liu L#, Luo GZ#, Yang W#, Zhao X#, Zheng Q, Lv Z, Li W, Wu HJ, Wang L, Wang XJ*, Zhou Q*. Activation of the imprinted Dlk1-Dio3 region correlates with pluripotency levels of mouse stem cells. (2010) J Biol. Chem. 285(25):19483-19490. doi: 10.1074/jbc.M110.131995.
- Zhao XY#, Li W#, Lv Z#, Liu L, Tong M, Hai T, Hao J, Guo CL, Ma QW, Wang L, Zeng FY*, Zhou Q*. iPS cells produce viable mice through tetraploid complementation. (2009) Nature 461(7260):86-90. doi: 10.1038/nature08267.
发现了一个表达与小鼠干细胞的多能性水平正相关的基因簇,使可以在早期对干细胞的多能性水平进行判断
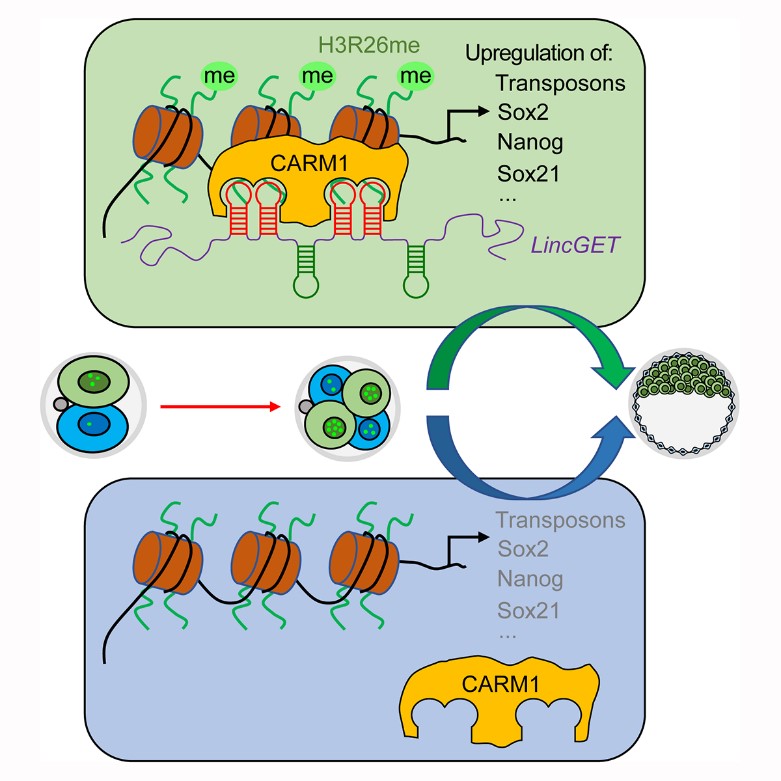
LincGET在2-细胞期的两个卵裂球之间不均等表达,通过CARM1调控细胞命运选择
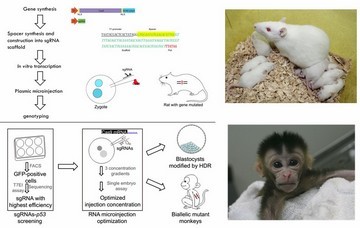
利用CRISPR-Cas基因修饰系统一步获得多基因多位点修饰转基因大鼠和基因敲除猴
|

